
Ganganalysen und Bruchsimulationen
Das Projekt Smarte Implantate geht in den zweiten Teil der Finanzierungsphase. Die Forschenden haben einen guten Überblick über den Heilungsverlauf von Knochenbrüchen gewonnen. Nun geht es darum, das Wissen zu bündeln – und in ein neuartiges Implantat zu verpacken.
Drei Jahre Forschungsarbeit seien nötig gewesen, um wirklich Neuland zu betreten, sagt Tim Pohlemann, Direktor der Klinik für Unfall-, Hand- und Wiederherstellungschirurgie am Universitätsklinikum des Saarlandes. Er leitet gemeinsam mit seiner Kollegin Bergita Ganse das Projekt Smarte Implantate, das von der Werner Siemens-Stiftung seit 2019 unterstützt wird. Mit Hilfe neuartiger Technologien aus der Materialtechnik entwickelt das Saarländer Team intelligente Implantate, welche die Heilung von komplizierten Knochenbrüchen verbessern sollen, indem sie den Heilungsprozess überwachen, bei Fehlbelastungen warnen – und durch eigene, gezielte Bewegungen an der Bruchstelle den Heilungsprozess anregen.
Von der Klinik über die Simulation und die Computertechnik bis zur technischen Entwicklung habe jeder Forschungsbereich in dem Projekt zuerst sein eigenes Feld voranbringen müssen, sagt Pohlemann. «Nun aber können wir das neue Wissen konsolidieren und so zusammenbringen, dass wir in die Richtung eines anwendbaren Implantats kommen.»
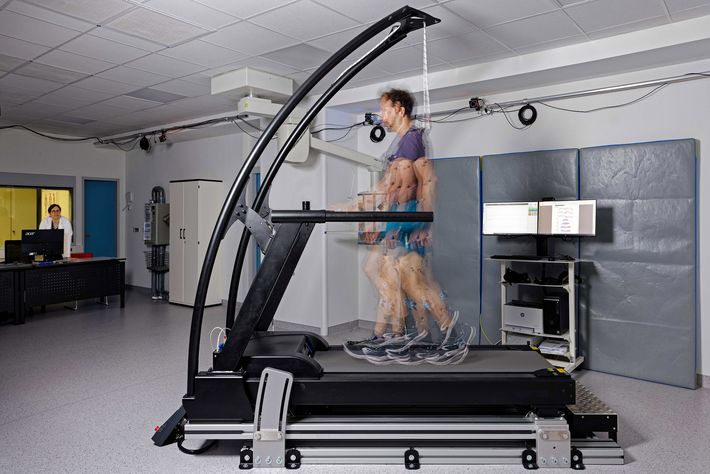
Was hat der Patient getan?
Ein Bereich, in dem die Forschenden im vergangenen Jahr besonders vorankamen, sind die Ganganalysen. «Wir haben inzwischen 90 Patienten in unsere Untersuchungen eingeschlossen und bei ihnen Daten über den Verlauf ihrer Knochenbruchheilung erhoben – im Labor und bei ihnen zuhause», erklärt Bergita Ganse, Werner Siemens-Stiftungsprofessorin für innovative Implantatentwicklung an der Universität des Saarlandes. Dies geschah mittels sogenannter Wearables – dünner, mit Druck-, Beschleunigungs- und Belastungssensoren bestückter Messsohlen, welche die Patienten in ihre Schuhe einlegten.
«Wir haben damit erste Langzeitdaten generiert und viele, inzwischen publizierte Ergebnisse gewonnen», sagt Ganse. Ein wichtiges Ziel ist es herauszufinden, welche Parameter sich im Heilungsverlauf wie verändern. Und darauf aufbauend jene Messwerte zu identifizieren, welche möglichst rasch anzeigen, dass die Heilung unerwünscht verläuft. «Wir haben viele Patienten, deren Knochenbruch geheilt ist», sagt Ganse, «aber leider gibt es noch zu viele, bei denen die Heilung ausbleibt.» Ein Parameter, der auf eine schlechte Heilung hindeuten könnte, ist laut ihr der Kraftunterschied zwischen rechtem und linkem Fuss. Ein anderer die Bewegung des Schwerpunkts unter der Fusssohle. «Wir können aus den Daten auch sehen, wie oft ein Patient das Bein hochgelegt hat», sagt Ganse. «Jedes einzelne Bewegungsmuster und seine Verteilung müssen nun im Zusammenhang mit der Heilungsprognose analysiert werden.»
Wichtig ist es aber auch, die Gründe für die von der Sohle gemessenen Belastungen oder Beschleunigungen auseinanderzuhalten. «Wenn wir hohe Beschleunigungen messen, müssen wir wissen, ob der Patient gerannt oder Bus gefahren ist», sagt Tim Pohlemann. Untersucht haben die Forschenden auch die Effekte des Untergrunds (Asphalt, Sand, Wiese, Schotter) und der Topographie (Bergaufgehen, Bergabgehen, Treppensteigen) auf die Kraftkurve in der Sohle. Der Grund dafür liege in der Patientensicherheit, erklärt Bergita Ganse. Denn wenn dereinst ein intelligentes Implantat im Bein des Patienten steckt, soll es bei gefährlichen Fehlbelastungen Alarm schlagen und allenfalls Gegensteuer geben. Doch dazu muss es die verschiedenen Faktoren unterscheiden können, welche zu einer Belastungsänderung im Bein führen. Bei diesen Berechnungen sind statistische Standardverfahren oft überfordert. Um die schwer zu erkennenden Korrelationen aufzuspüren, haben die Forschenden deshalb spezifische KI-Algorithmen entwickelt.
Wie viel Bewegung ist nötig?
Schöne Resultate können die Forschenden auch im Bereich der Computersimulationen vorweisen. «Wir nutzen Computertomographie-Daten von Patienten, um Knochenbrüche an verschiedenen Stellen und in verschiedenen Winkeln zu simulieren», erzählt Bergita Ganse. Das Ziel: Herausfinden, wie stark sich das Implantat dereinst – abhängig vom Bruchtyp – bewegen muss, um die Heilung optimal zu steuern.
Das ist keine einfache Aufgabe. Zum einen gibt es komplizierte Bruchtypen, zum Beispiel keilförmige Brüche, bei denen die Belastungen und Druckverteilungen komplex sind. Zum anderen gilt es auch, zeitliche Veränderungen in Betracht zu ziehen. «Die Steifigkeit des Gewebes nimmt während der Heilung zu, dann werden andere Kräfte nötig», sagt Bergita Ganse.
Solche Computersimulationen seien ein entscheidender Schritt, um herauszufinden, was das Implantat können müsse, ergänzt Tim Pohlemann. «Denn das ist der Kern des Projekts: Wir müssen das Implantat so bauen, dass es am Ende auch wirklich die richtigen Bewegungen und Druckveränderungen erzeugt, um die Heilung zu unterstützen.»




